Informație revoluționara: Asimptomaticii ar fi imuni genetic la Covid-19!
Postat la: 21.10.2021 | Scris de: ZIUA NEWS
0
Posesorii unei imunități genetice la SARS-CoV-2 ar putea deține cheia celui mai eficient tratament împotriva virusului, sustin mai multi medici care s-au confruntat cu temuta boala pandemică.
"Infecțiile cu SARS-CoV-2 prezintă o variabilitate inter-individuală enormă, variind de la infecții asimptomatice la boli care pun viața în pericol", scrie un consorțiu de medici specializat în boli infecțioase, imunologie și genetică. Proveniți din Statele Unite, Brazilia, Olanda, Grecia și Franța, aceștia sunt convinși că indivizii asimptomatici au o specificitate de exploatat: ar fi imuni genetic la Covid-19. Oamenii de știință vor să le studieze genetica pentru a dezvolta tratamente împotriva pandemiei. Consorțiul a publicat un articol în revista Nature Immunology, intitulat "A global effort to dissect the human genetic basis of resistance to SARS-CoV-2 infection".
Potrivit acestuia, "variabilitatea clinică a răspunsului la infecție" ar putea fi explicată prin factori genetici umani. Pentru a-și susține ipoteza, echipa de cercetare expune ca argument: familiile care au raportat că toți membrii, cu excepția unuia, s-au infectat, sugerând "că unii indivizi foarte expuși pot fi rezistenți la infecția cu acest virus". În timp ce vaccinurile au sosit suficient de rapid pentru a atenua pandemia, oamenii de știință care au realizat studiul susțin că persoanele potential imunizate genetic dețin cheia celui mai eficient tratament împotriva virusului.
Imunitățile naturale au fost întotdeauna studiate și explorate pentru a lupta împotriva virușilor precum HIV, spre exemplu, pentru a găsi remedii. În ciuda cunoștințelor limitate privind "bazele genetice și imunologice umane ale rezistenței înnăscute la SARS-CoV-2" , experții consideră că asimptomaticii sunt o dovadă suficientă pentru a orientarea cercetării tratamentului în această direcție. Ei sugerează instituirea unui proces în patru etape pentru a-i găsi pe acești indivizi, a-i recruta și a-i studia. Căutarea lor ar începe cu cazuri neinfectate într-o familie afectată de Covid-19.
"Vom lua în considerare apoi persoanele expuse la un caz index fără echipament individual de protecție, timp de cel puțin o oră pe zi și în primele trei până la cinci zile de simptome în cazul index", spun cercetatorii. Procesul va continua cu "indivizi cu rezultate PCR negative la testare și rezultate serologice negative obținute la patru săptămâni după expunere" . În cele din urmă, oamenii de știință vor evalua "răspunsurile limfocitelor T specifice la SARS-CoV-2 la persoanele candidate rezistente și vor compara răspunsurile lor cu cele ale persoanelor infectate cu SARS-CoV-2". 4.000 de persoane au răspuns deja la apelul.
Traducerea articolului din Nature Immunology:
Abstract
Infecțiile cu SARS-CoV-2 prezintă o variabilitate interindividuală enormă, de la infecții asimptomatice la boli care pun în pericol viața. Erorile congenitale și autoanticorpii direcționați împotriva interferonilor de tip I (IFN) reprezintă aproximativ 20% din cazurile critice de COVID-19 în rândul persoanelor infectate cu SARS-CoV-2. În schimb, determinanții genetici și imunologici ai rezistenței la infecție în sine rămân necunoscuți. În urma descoperirii faptului că deficiența autosomal recesivă a receptorului de chemokine DARC conferă rezistență la Plasmodium vivax, s-a demonstrat că deficiențele autosomale recesive ale receptorului de chemokine 5 (CCR5) și ale enzimei FUT2 stau la baza rezistenței la HIV-1 și, respectiv, la norovirusuri. În aceeași ordine de idei, propunem o strategie pentru identificarea, recrutarea și analiza genetică a persoanelor care sunt rezistente în mod natural la infecția cu SARS-CoV-2.
Principal
Pandemia COVID-19 ne-a reamintit că infecțiile sunt unice în rândul bolilor prin potențialul lor de a provoca rapid o morbiditate și o mortalitate masivă la nivel mondial. De-a lungul istoriei, bolile infecțioase au impus presiuni de selecție puternice asupra oamenilor1,2,3. În special, pandemiile virale, inclusiv cele cauzate de coronavirusuri, au avut loc în mod repetat în ultimul secol și, probabil, de-a lungul întregii istorii umane4,5,6,7. Variabilitatea clinică a răspunsului la o infecție, virală sau de altă natură, poate fi explicată, cel puțin la unii indivizi, prin factori genetici umani8. Introducerea SARS-CoV-2 la o populație naivă, la scară globală, a oferit încă o demonstrație a variabilității clinice remarcabile între indivizi în cursul infecției, de la infecții asimptomatice la boli care pun în pericol viața9,10,11. Înțelegerea noastră cu privire la fiziopatologia COVID-19, care pune în pericol viața, a progresat considerabil de când boala a fost descrisă pentru prima dată în decembrie 2019 (ref. 12,13), dar știm încă foarte puțin despre baza genetică și imunologică umană a rezistenței înnăscute la SARS-CoV-2. Ratele medii de atac secundar pentru infecțiile cu SARS-CoV-2 pot ajunge până la 70 % în anumite gospodării14,15 și au fost raportate mai multe familii în care toți membrii, cu excepția unuia dintre soți, sunt infectați16, ceea ce sugerează că unele persoane foarte expuse pot fi rezistente la infecția cu acest virus. În continuare, trecem în revistă exemple de susceptibilitate determinată genetic la rezultate grave ale două boli infecțioase - tuberculoza (TB) și COVID-19 -, abordând în același timp mai în profunzime cele trei cazuri cunoscute de rezistență înnăscută la infecții. Apoi, analizăm genele candidate direct relevante pentru rezistența la infecția cu SARS-CoV-2. În cele din urmă, propunem o strategie de recrutare și analiză genetică a persoanelor care sunt rezistente în mod natural la infecția cu virusul. Mai presus de toate, pledăm pentru continuarea studiilor pentru a ne dezvolta înțelegerea mecanismelor cauzale ale rezistenței înnăscute la infecția cu SARS-CoV-2 și oferim un cadru pentru utilizarea acestor cunoștințe în scopuri terapeutice.
Susceptibilitatea înnăscută la boli infecțioase care pun viața în pericol
Evoluția umană a fost marcată de microorganisme suficient de patogene pentru a exercita o presiune selectivă asupra genelor cruciale pentru apărarea gazdei2. Unul dintre cele mai mortale flageluri ale sănătății umane este tuberculoza, care a provocat aproximativ un miliard de decese în Europa în ultimele două milenii17. În mod paradoxal, mai puțin de 10 % dintre oamenii infectați cu Mycobacterium tuberculosis dezvoltă TB. De la începutul secolului al XX-lea, contribuția geneticii umane la patogeneza TB a fost descifrată prin studii genetice clasice și experimentale18,19. Mai recent, erori înnăscute rare ale imunității (IEI), inclusiv deficiențe autosomale recesive ale receptorului β1 al interleukinei-12 (IL12RB1)20,21 și ale tirozinei kinazei 2 (TYK2)22, în special, au fost identificate la câteva persoane cu TB. Relevanța mai largă a acestei constatări a fost demonstrată atunci când analiza a fost extinsă la variante mai comune, dezvăluind că homozigozitatea pentru polimorfismul TYK2(P1104A) a fost asociată cu un risc ridicat de a dezvolta TB17,23. Homozigozitatea p.P1104A întrerupe capacitatea TYK2 de a media imunitatea la micobacterii dependentă de IL-23 IFN-γ23. Frecvența alelei sale minore este cea mai mare în rândul europenilor17. O analiză a ADN-ului străvechi a arătat că frecvența TYK2(P1104A) a scăzut puternic în ultimii 2 000 de ani în Europa, datorită unei selecții negative puternice, concomitent cu povara ridicată a tuberculozei în Europa24.
Odată cu apariția pandemiei de COVID-19, s-a demonstrat că anumite IEI specifice au un rol în definirea susceptibilității la COVID-19 sever. COVID Human Genetic Effort (http://www.covidhge.com) a raportat 23 de bolnavi în stare critică cu IEI la 8 loci care guvernează inducția și amplificarea IFN de tip I dependentă de TLR3 și IRF713. În mod remarcabil, patru adulți neînrudiți și anterior sănătoși prezentau un deficit autosomal recesiv de IRF7 sau IFNAR1. Deși rare, persoanele cu IEI demonstrează că imunitatea IFN de tip I este indispensabilă pentru controlul infecției cu SARS-CoV-2. Această constatare a dus la descoperirea ulterioară, tot de către consorțiu, a autoanticorpilor neutralizanți preexistenți împotriva IFN de tip I, ca o fenotip al IEI legate de IFN de tip I12. Studii ulterioare efectuate în cohorte independente au confirmat prezența autoanticorpilor neutralizanți împotriva IFN de tip I la peste 10 % dintre persoanele cu COVID-19 severă (ref. 25,26,27,27,28,29,30). Mai recent, consorțiul a constatat că autoanticorpii care neutralizează concentrații mai mici, mai fiziologice de IFN de tip I reprezintă aproximativ 20% din pacienții cu vârsta peste 70 de ani cu pneumonie critică31. Mai mult, consorțiul a raportat, de asemenea, că aproximativ 1% dintre pacienții de sex masculin cu vârsta mai mică de 60 de ani cu pneumonie critică prezintă un deficit de TLR7 X-recesiv32. În mod surprinzător, persoanele cu IEI identificate și cele cu autoanticorpi nu au manifestat o sensibilitate deosebită la alte boli infecțioase grave înainte de expunerea la SARS-CoV-2. Această constatare este în concordanță cu cantitățile mai mici de IFN de tip I induse de SARS-CoV-2 decât de virusul gripal sezonier, de exemplu33. Cu toate acestea, s-a demonstrat că autoanticorpii IFN de tip I stau la baza unei treimi din reacțiile adverse la vaccinul cu virus viu atenuat al febrei galbene34. În mod colectiv, aceste exemple ilustrează modul în care elucidarea genetică a unui deficit imunologic la câteva persoane rare poate indica un mecanism care este perturbat de alte cauze la mult mai multe persoane.
Rezistența înnăscută la infecție în urma expunerii
Protecția determinată genetic a unui individ împotriva unei boli infecțioase este imaginea în oglindă a susceptibilității determinate genetic la o boală care pune în pericol viața. Termenul de "protecție" se aplică unui anumit locus atunci când alela asociată cu un risc mai mic de boală este cea mai puțin frecventă, alela alternativă. Mult mai puține studii genetice privind bolile infecțioase s-au concentrat asupra alelelor protectoare decât asupra susceptibilității la infecții, fie că este vorba de boli monogenice sau poligene. La începutul anilor 1950, Anthony Allison a arătat că trăsătura HbS a celulelor secerătoare se menține la o frecvență ridicată în zonele africane unde malaria este endemică, datorită unui avantaj heterozigot1 al alelei de a oferi protecție împotriva infecțiilor severe cu Plasmodium falciparum35. Alte exemple de protecție împotriva rezultatelor slabe ale infecției includ apariția unor alele HLA de clasă I specifice la persoanele infectate cu HIV-1 care nu evoluează pe termen lung36 și rolul unui haplotip de interferon de tip III (IFNL3-IFNL4) în eliminarea virală în urma infecției cu virusul hepatitei C (HCV)37,38. Aceste alele conferă protecție împotriva bolii grave la persoanele infectate, dar nu și împotriva contracției infecției propriu-zise.
Determinismul genetic al rezistenței la infecție a fost chiar mai puțin studiat decât cel al protecției împotriva rezultatelor slabe ale infecției, iar studiul a fost întotdeauna din unghi monogenic. Până în prezent au fost identificate doar trei mecanisme de rezistență mendeliană la infecție. În anii 1970, Louis Miller a descoperit că absența antigenului Duffy pe eritrocite a împiedicat aceste celule să se infecteze cu Plasmodium vivax39,40. Baza genetică moleculară a acestei trăsături de rezistență autosomal recesivă a fost determinată abia în anii 1990. Varianta cauzală afectează situsul de legare GATA-1 din promotorul DARC, împiedicând în mod selectiv transcrierea genei în celulele eritroide41. Aproximativ în același timp, s-a constatat că deficitul autosomal recesiv de CCR5 conferă rezistență la infecția cu HIV-1 (ref. 42,43,44). Cea mai frecventă mutație de pierdere a funcției în CCR5 este o deleție de 32 de perechi de baze, cu o frecvență a alelei minore de 10 % în populația europeană. În cele din urmă, s-a descoperit că deficitul autosomal recesiv FUT2 conferă rezistență la infecțiile gastrointestinale cu norovirusuri45. Ca și în cazul DARC și al proteinei de legare Duffy din P. vivax, precum și al CCR5 și al heterodimerului HIV-1 gp120-gp41, expresia FUT2 este necesară pentru legarea capsidei VPg a norovirusului. Probabil că nu este o coincidență faptul că aceste exemple de rezistență mendeliană la infecție sunt deficiențe complete ale receptorilor sau coreceptorilor exploatați de agentul patogen ca mijloc de pătrundere în celule. Mecanismele genetice de protecție împotriva rezultatelor infecțioase grave și cele care stau la baza rezistenței la infecție în sine sunt ambele supuse selecției pozitive, deoarece oferă un avantaj de supraviețuire46.
Genele candidate de rezistență la SARS-CoV-2
Nu se cunoaște proporția de oameni care sunt rezistenți în mod natural la infecția cu SARS-CoV-2, dar mai multe gene candidate potențial implicate în rezistența înnăscută a oamenilor la infecția cu SARS-CoV-2 au fost identificate pe baza mai multor surse de dovezi. Una dintre acestea este locusul ABO, care a fost identificat în studiile de asociere la nivelul întregului genom (GWAS)47,48. Deși datele inițiale privind impactul grupului sanguin asupra severității COVID-19 au fost inconsecvente, o metaanaliză recentă a aproape 50 000 de persoane din 46 de studii a confirmat un efect al acestui locus asupra susceptibilității la infecție49. Cu toate acestea, efectul protector al alelei O este mic, cu un odds ratio de ~0,90. Deși nu a fost propus încă niciun mecanism unificat de rezistență50, grupurile sanguine ABO pot juca un rol direct în infecție, servind drept coreceptori pentru SARS-CoV-2 (ref. 47). Pernioza asociată pandemiei (chilblain) este o manifestare rară la persoanele expuse la SARS-CoV-2, care ar putea oferi informații despre mecanismele de rezistență la infecție51,52. Pernio asociat pandemiei ("degetele de la COVID") imită leziunile cutanate ale lupusului familial chilblain și ale sindromului Aicardi-Goutières, tulburări monogenice cauzate de mutații care duc la o suprareglare a semnalizării IFN de tip I53. Majoritatea persoanelor cu pernio rămân seronegative, dar prezența proteinei spike a SARS-CoV-2 a fost demonstrată în probele de biopsie cutanată și s-a observat, de asemenea, un răspuns local robust la IFN de tip I, sugerând o eliminare timpurie a virusului54. Aceste observații implică prezența infecției și, prin urmare, absența unei rezistențe naturale la infecție. Cu toate acestea, prin înțelegerea fiziopatologiei acestui fenomen, am putea face lumină asupra mecanismelor gazdei care restricționează replicarea virală și promovează rezistența la infecția cu SARS-CoV-2.
Studiile in vitro privind interactiomul au identificat alte gene gazdă candidate care susțin ciclul de viață viral. La începutul pandemiei, s-a descoperit că infecția cu SARS-CoV-2 este dependentă de receptorul ACE2 pentru intrarea în celule și de serin-proteinaza TMPRSS2 pentru amorsarea proteinei spike55,56,57,58. Într-adevăr, prin GWAS, s-a constatat că o variantă rară localizată în apropierea ACE2 conferă protecție împotriva infecției cu SARS-CoV-2, posibil prin reducerea expresiei ACE259. Mai mult, deși impactul lor asupra infecției este necunoscut, unele polimorfisme ACE2 umane se leagă de proteina spike a SARS-CoV-2 cu afinități diferite in vitro60. În cadrul unui screening CRISPR knock-out la nivelul genomului pentru infecția cu SARS-CoV-2 și alte coronavirusuri, TMEM41B a fost identificat ca fiind necesar pentru o infecție permisivă cu virusul61. TMEM41B este o proteină transmembranară din reticulul endoplasmatic care este, de asemenea, necesară pentru flavivirusuri62. Impactul său asupra infecției cu SARS-CoV-2 rămâne de stabilit, dar s-a demonstrat că o alelă comună la asiaticii de est și de sud este asociată cu o capacitate mai mică de a susține infecția cu flavivirus in vitro62. La fel ca în cazul ecranelor CRISPR knockout la nivelul genomului, purificarea prin afinitate-spectrometrie de masă a proteinelor umane care interacționează cu SARS-CoV-2 a produs o hartă extinsă a interacțiunilor proteice63,64. Evaluările funcționale ale acestui interacționom au dus la transpunerea sa într-un catalog de factori gazdă esențiali necesari pentru infecția cu SARS-CoV-265. Deși nu au fost publicate încă studii la om care să stabilească o legătură între interactomul SARS-CoV-2 și susceptibilitatea la infecție, genele în cauză - împreună cu loci identificați prin GWAS - pot fi considerate drept candidate pentru identificarea variantelor înnăscute care conferă rezistență la infecție.
Strategii genetice și imunologice
Există două provocări cheie în căutarea persoanelor rezistente în mod natural la infecția cu SARS-CoV-2. În primul rând, demonstrarea absenței infecției reprezintă un obstacol în ceea ce privește diagnosticarea. Abordările de diagnosticare moleculară bazate pe PCR care utilizează probe respiratorii oferă doar informații instantanee. Serologia este utilă pentru evaluarea apariției unor infecții anterioare pentru multe infecții virale, dar unele persoane rămân seronegative în ciuda infecției cu SARS-CoV-2 (ref. 66,67). Imunitatea încrucișată preexistentă mediată de celulele T ca urmare a infecțiilor anterioare cu alte coronavirusuri ar putea contribui la un răspuns rezistent la infecția cu SARS-CoV-2 (ref. 68,69,70,71). În același timp, răspunsurile celulelor T la antigene specifice SARS-CoV-2 ar putea constitui un marker sensibil și specific pentru evaluarea calitativă a infecției anterioare cu SARS-CoV-2 (ref. 68). O a doua provocare constă în probabilitatea de transmitere a virusului. Probabilitatea de infectare este influențată atât de durata și intensitatea expunerii la un individ infectat, cât și de caracteristicile intrinseci de transmitere ale agentului patogen. Numărul de reproducere de bază (R0, numărul mediu de infecții secundare produse de un caz tipic de infecție într-o populație în care toată lumea este sensibilă) al SARS-CoV-2 este cuprins între 2,5 și 5,0, în medie72,73,74. Cu toate acestea, se știe că coronavirusurile sunt transmise în timpul unor evenimente de superspariție cu rate foarte mari de atacuri secundare75. Identificarea acestor evenimente, a altor focare de amploare și a gospodăriilor în care unul sau foarte puțini indivizi au rămas neinfectați14,15,16 ar prezenta un interes deosebit pentru studiul variantelor înnăscute care conferă rezistență la SARS-CoV-2.
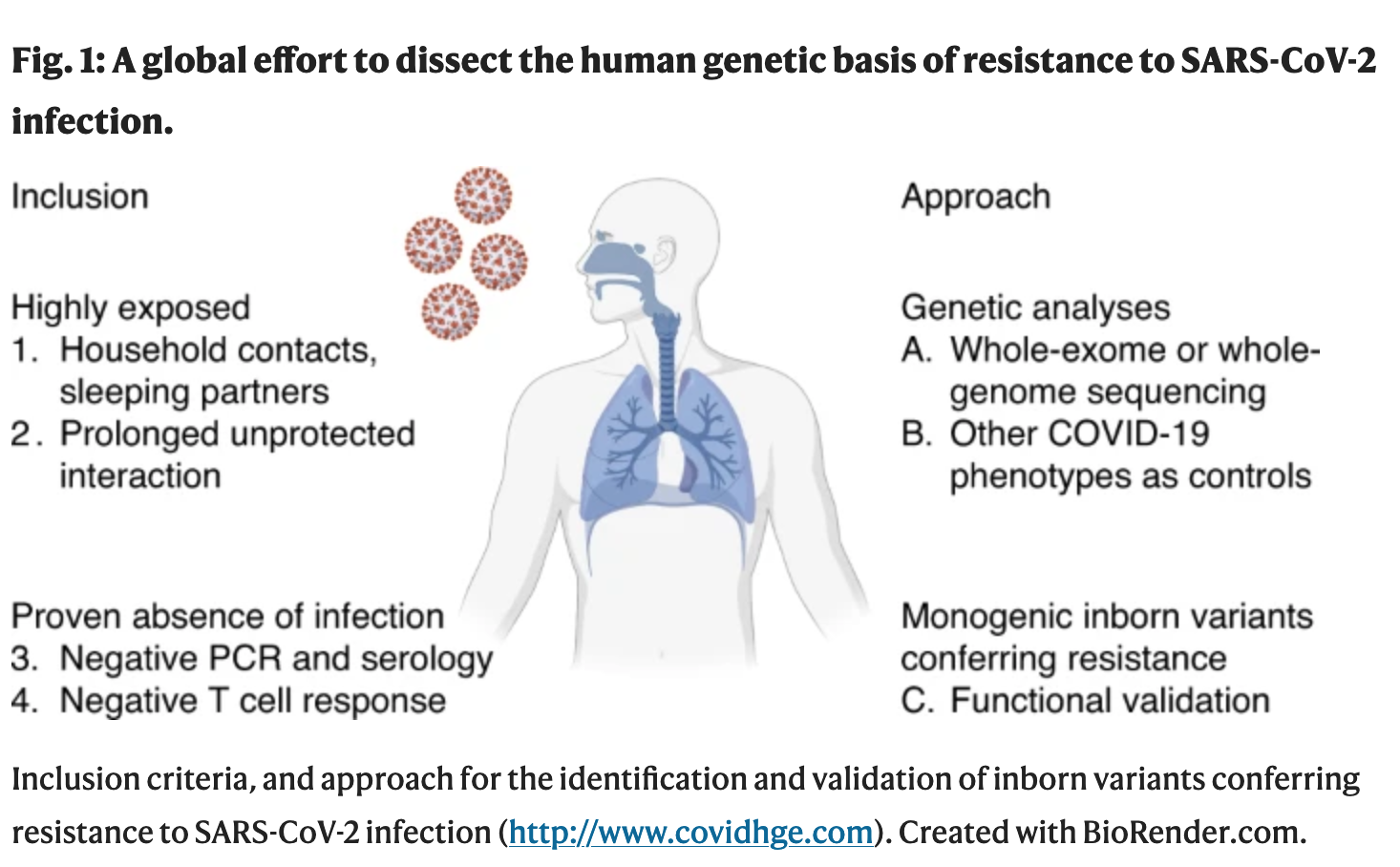
Atunci când testăm ipoteza că variantele monogenice înnăscute ale imunității conferă rezistență naturală la infecția cu SARS-CoV-2, aplicăm o strategie în patru etape pentru a depăși limitările de diagnostic și incertitudinile privind expunerea (Fig. 1). În primul rând, ne concentrăm pe contactele casnice neinfectate ale persoanelor cu COVID-19 simptomatic (scor de 3 sau mai mare pe scala de progresie clinică a Organizației Mondiale a Sănătății76). Apoi luăm în considerare persoanele expuse la un caz index fără echipament de protecție personală, timp de cel puțin 1 oră pe zi și în primele 3-5 zile de simptome ale cazului index. Se acordă prioritate studiului soților și partenerilor de somn serodiscordanți. Înscriem ulterior persoanele cu un rezultat negativ al PCR în momentul testării, plus rezultate serologice negative obținute la 4 săptămâni după expunere. În cele din urmă, evaluăm răspunsurile celulelor T specifice SARS-CoV-2 la persoanele candidate rezistente și comparăm răspunsurile acestora cu cele ale persoanelor infectate cu SARS-CoV-2. Diferențiem răspunsurile celulelor T induse de vaccinare de cele provocate de infecția naturală. Participanții la studiu lipsiți de un răspuns al celulelor T reactive la SARS-CoV-2 vor fi analizați prin secvențierea genomului/exomului întreg. Rezultatele vor fi comparate cu cele ale martorilor infectați cu SARS-CoV-2, cu scopul de a identifica variantele rare sau comune cu un efect puternic asupra rezistenței la infecție11,12,13,77. În cele din urmă, la fel ca în studiile privind IEI78, rezultatele genetice vor fi validate experimental, inclusiv cu celule de la participanții la studiu, pentru a diseca mecanismele de rezistență la nivel molecular, celular, tisular, imunologic și la nivelul întregului organism (Fig. 1).
Observații finale
Exemplele istorice de rezistență înnăscută la infecția cu alți agenți patogeni oferă o foaie de parcurs pentru testarea ipotezei rezistenței înnăscute monogenice la infecția cu SARS-CoV-2. Unele variante mai comune de rezistență înnăscută în genele candidate pot avea efecte relativ mici. Cu toate acestea, ne propunem, de asemenea, să identificăm genele candidate cu variante potențial rare și cu o dimensiune mare a efectului. Aceste variante prezintă un interes deosebit din două motive. În primul rând, ele pot oferi o înțelegere profundă a căilor biologice esențiale implicate în infecția cu SARS-CoV-2. În al doilea rând, ele vor permite dezvoltarea unor intervenții terapeutice inovatoare pentru a preveni sau trata infecția cu SARS-CoV-2 la alte persoane. Dovada de principiu pentru acest al doilea motiv de interes a fost furnizată de CCR5 și de antagonistul său, maraviroc, care este utilizat pentru tratamentul infecțiilor cu HIV-1 în anumite contexte79. În plus, transplantul de măduvă osoasă cu deficit de CCR5 a fost aplicat cu succes pentru a vindeca infecția cu HIV la câteva persoane80,81. De la începutul pandemiei, nu a fost descoperit niciun medicament specific eficient împotriva COVID-19. Lecțiile învățate din experimentele din natură ar putea să ne ghideze către astfel de tratamente specifice pentru COVID-19. Am înrolat deja peste 400 de persoane care îndeplinesc criteriile de includere într-o cohortă dedicată studiului de rezistență. Înscrierea colaborativă a participanților la studiu continuă (http://www.covidhge.com), iar subiecții din întreaga lume sunt bineveniți.
DIN ACEEASI CATEGORIE...

ULTIMA ORA
-
WSJ: Liderii de război ai Israelului nu au încredere unii în alţii. Netanyahu, ministrul Apărării şi fostul șef al Armatei nu se pun de acord
După şase luni de conflict împotriva Hamas, publicul israelian este profund divizat în ceea ce priveşte modul în care se poate câştiga războiul din Fâşia Gaza. La fel sunt şi cei trei înalţi oficiali ai cabinetului de război, un organism care atunci când a fost format, era menit tocmai să încurajeze unitatea în acest efort, scrie The Wall Street Journal (WSJ).
-
Politico: Ucraina se îndreaptă spre înfrângere. Starea de spirit a populației și moralul soldaților s-au prăbușit
Întrebați doar un soldat ucrainean dacă mai crede că Occidentul va sta alături de Kiev „atât timp cât va fi nevoie". Această promisiune sună a gol când au trecut patru săptămâni de când unitatea ta de artilerie a avut ultima dată un obuz de tras, așa cum s-a plâns un militar de pe front.
-
NASA: China folosește programe civile pentru a ascunde obiective militare în spațiu
Şeful agenţiei spaţiale americane NASA, Bill Nelson, a declarat miercuri în Congres că China foloseşte programe civile pentru a ascunde obiective militare în spaţiu, relatează DPA.
-
Documente secrete ale Rusiei dezvăluite de Washington Post: Strategia lui Putin asupra Statelor Unite pentru O Nouă Ordine Mondială
Concomitent cu războiul din Ucraina, Vladimir Putin a realizat un concept de politică externă al Rusiei, special țintit împotriva Statelor Unite și a aliaților săi occidentali. Presa americană dezvăluie documente secrete de la Moscova, care prezintă un plan prin care Rusia vrea să scoată din joc SUA și să distrugă NATO.
-
Vice-guvernatorul băncii centrale din Israel spune că rolul numerarului s-a „erodat" și e depășit tehnologic. El a anunțat testarea șekelului digital
Andrew Abir, guvernatorul adjunct al Băncii Israelului, a spus recent că numerarul tradițional a fost cândva competitiv cu alte metode de plată, dar rolul său s-a „erodat" din cauza limitărilor tehnologice, pe măsură ce finanțele devin din ce în ce mai digitale, potrivit Cryptoslate.
-
Baba Vanga și Nostradamus profețesc Al Treilea Război Mondial: ce oras va arde din temelii la inceputul conflagratiei
Baba Vanga este renumită pentru serie sa de previziuni, unele dintre ele extrem de tulburătoare. Multe dintre acestea au fost consemnate de presă încă din timpul vieții ei. Chiar și după moartea sa în 1996, numele și influența sa persistă, fiind adesea invocat când vine vorba de capacitatea de a vedea în viitor.
-
Israelul pregătește o mare operațiune terestra: armata a fost pregătită și a primit arme cu mare putere de foc
Israelul ar fi desfăşurat artilerie suplimentară şi transportoare blindate de trupe la periferia Fâşiei Gaza, ceea ce sugerează că armata se pregăteşte pentru ofensiva terestră, ameninţată de mult timp, asupra Rafah, singurul loc relativ sigur pentru cel puţin 1,4 milioane de civili palestinieni strămutaţi.
-
Industria României crește prin programele adoptate de PSD la guvernare
Programul de Guvernare al PSD, centrat pe investiții publice record și susținerea firmelor care produc în România au pus industria țării pe un curs ascendent, cu progrese vizibile față de anul precedent, dar și de la lună la lună. Per ansamblu, cifra de afaceri din industrie a crescut cu 5,4% în termeni nominali, în primele două luni ale acestui an, comparativ cu aceeaşi perioadă din 2023.
-
Angajații Google cer anularea unui contract uriaș al companiei cu guvernul israelian. Protestatarii, scoși cu forța din birouri de polițiști
Zeci de angajați Google au participat la proteste în birourile companiei din New York și California. Gigantul IT are un contract de peste un miliard de dolari cu guvernul israelian, însă tot mai mulți angajați condamnă situația din Fâșia Gaza. A fost chemată și poliția pentru a-i scoate pe protestatari din birourile companiei marți, 16 aprilie.
DIN CATEGORIE
- TOP CITITE
- TOP COMENTATE
- 1.S-a decis data de la care UE va interzice sobele pe lemne și în România. Cine ne dă bani pentru pompe de căldură
- 2.O invenție revoluționară. Levitația a devenit posibilă
- 3.Misiune indeplinita: Anca Dragu a predat Republica Moldova la cheie pentru companiile străine care sunt deja în România
- 4.Yuval Noah Harari: "Când va veni potopul elitele vor construi o arcă și îi vor lăsa pe ceilalți să se înece!"
- 5. Poti sa pierzi tot prin Escrocheria "Mă auziți acum?" Motivul pentru care să nu răspunzi cu "Da"
- 6.Cei patru factori care au provocat criza de sănătate mintală Generației Z: iPhone, netul de mare viteză, camera frontală și viralizarea conținutului pe rețelele sociale
- 7.Sute de mii de japonezi se revoltă împotriva "Tiranicului Tratat privind pandemiile al OMS"!
- 8.Sindromul " România": Peste jumătate dintre britanici se gândesc să părăsească Marea Britanie pentru a lucra în străinătate
- 9.Se pregătește pandemia de gripă aviara cu transmitere la om ca sa se puna in aplicare tratatul OMS
- 10.Virolog de top despre vaccinați: "Urmează un tsunami al deceselor Covid care va provoca haos economic si social. Cineva trebuie sa spuna adevarul!"


comentarii
Adauga un comentariuAdauga comentariu