Intrebarea-cheie: Care este diferența între autorizația de urgență a vaccinului contra Covid-19 și cea completă?
Postat la: 24.08.2021 | Scris de: ZIUA NEWS
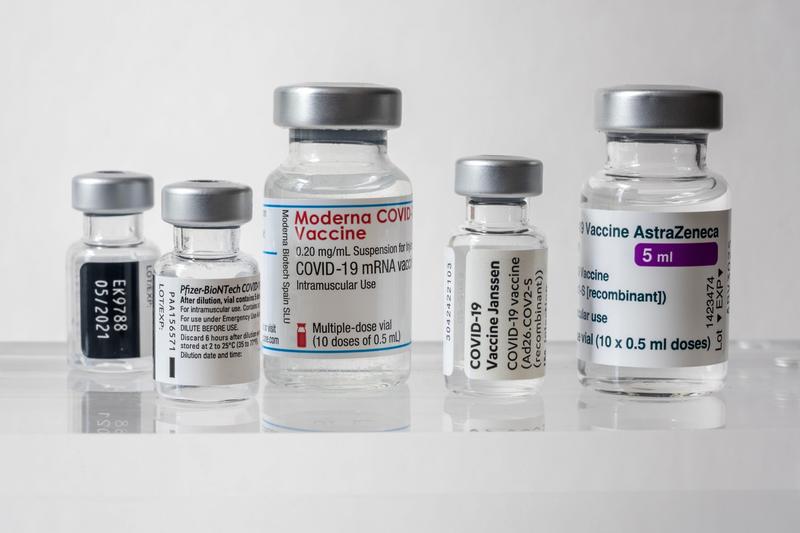
Autorizația pentru utilizarea de urgență (EUA) a primit multă atenție în timpul pandemiei. Conceptul Asociației pentru Alimente și Medicamente a SUA (FDA) de autorizare a unui produs sau a unui tratament în mod rapid, fără o analiză absolut completă a fost introdus în anul 2005, scrie ContagionLive.
La acel moment, FDA a emis o EUA pentru vaccinul contra antraxului, disponibil pentru personalul militar, după apariția unor scrisori cu antrax ce au ucis sau împolnăvit peste 20 de oameni. În următorii ani, au fost emise EUA pentru o varietate de terapii experimentale pentru boli precum H1N1 (gripa porcină), MERS, Ebola și Zika, ce au apărut rapid și amenințau să devină pandemii. Începând de anul trecut, au fost emise mai multe autorizații de urgență pentru produse contra Covid-19, inclusiv teste de diagnosticare și de anticorpi, tratamente clinice și vaccinuri.
Potrivit Dianei Zuckerman, președintele National Center for Health Research din SUA, există mai multe motive pentru care o companie ar putea să nu ceară aprobarea totală a unui produs. "Unul dintre motive poate fi acela că se descoperă că nu funcționează, așa că nu se fac eforturi să fie aprobat, iar altul este că firma nu are neapărat motivația de a face cercetările necesare pentru aprobare din cauză că standardele pentru EUA sunt tot timpul mai reduse decât cele pentru aprobarea FDA", a spus ea.
"Dacă aprobarea FDA necesită un studiu mai mare, pe termen mai lung, cu mai mulți pacienți, s-ar putea să nu merite", a explicat experta, dând ca exemplu EUA date pentru diferite terapii contra virusului Ebola, care nu prezintă la acest moment un pericol pentru Statele Unite. Chiar dacă o companie vrea să primească aprobarea completă pentru un produs, poate întâmpina probleme dacă nu găsește destui pacienți pentru a participa în teste pe scară largă, a adăugat Susan Wood, profesor la Universitatea George Washington și fost angajat FDA.
Zuckerman și Wood spun că, în mod ideal, companiile care produc terapii ce primesc EUA continuă să caute aprobarea completă pentru aceste terapii, mai ales în condițiile în care aceste pot fi folosite și pentru alte boli decât cele gândite inițial. "Motivul pentru care am putut să ne mișcăm rapid cu Covid s-a datorat muncii făcute deja cu alți coronaviruși, asta chiar a fost o pregătire pentru situație. Chiar dacă este pentru o boală rară sau o viitoare pandemie pe care nu o putem prezice, a avea mai multe informații te ajută mai târziu", a afirmat Zuckerman.
Pentru companii, aprobarea completă este o măsură de controlare a situației. FDA poate retrage o EUA oricând, oprind o firmă să-și vândă produsul. În contrast, e nevoie de câțiva ani pentru ca agenția americană pentru medicamente să retragă o aprobare completă. De asemenea, firmele de asigurări, de obicei, nu acoperă produsele sub EUA, deși, în cazul vaccinurilor contra coronavirusului, guvernele plătesc nota de plată. Autorizațiile de urgență sunt menite să ajute oamenii să primească imediat ajutor, nu este un lucru neobișnuit ca teste sau terapii ce au primit EUA să se dovedească ineficiente.
În cazul testelor și tratamentelor pentru Covid-19, FDA a emis EUA pe care ulterior le-a revocat. De exemplu, în martie 2020, companiilor li s-a permis să vândă teste de anticorpi - menite să arate dacă ai avut sau nu Covid în trecut - fără să înainteze cereri pentru acordarea de EUA. În mai 2020, companiile au avut voie să vândă teste de diagnosticare a Covid timp de 15 zile lucrătoare înainte să fie obligate să depună cererile de EUA. În acea lună FDA a emis 84 de EUA pentru diferite laboaratoare și companii, iar alte 400 de cereri așteptau răspuns.
Dar, până în februarie 2021, fuseseră strânse destul date privind testările de FDA, care a respins 225 de teste diferite pentru anticorpi. De asemenea, deși în martie 2020 FDA dăduse autorizația de urgență pentru folosirea hidroxiclorochinei, până în iunie 2020 a devenit clar din studiile clinice că medicamentul nu numai că nu aduce beneficii clare, dar poate fi chiar dăunător pentru pacienții cu Covid, așa că EUA a fost retrasă în iunie 2020.
Lipsa aprobării complete a FDA a fost invocată și ca factor în reticența unor oameni de a primi vaccinul FDA și este și un punct central al disputei privind obligativitatea vaccinului. De obicei, obligativitatea vine după ani de experiență cu un vaccin. "În mod normal, testarea durează, procedurile dintre FDA și comapnii sunt lente, procesul de evaluare este lent și produsul ajunge pe piață în mod gradual", a explicat Wood.
La acel moment, există mai multă acceptare în rândul populației generale. "Acum, totul a fost comprimat, inclusiv EUA, și ajungem direct la obligativitatea (vaccinării pentru angajați) impusă de firme", a mai spus Wood. Vaccinul contra bolii provocate de coronavirus dezvoltat de Pfizer și BioNTech a primit luni autorizare deplină din partea Administrației pentru Medicamente și Alimente din SUA, decizie care ar putea ajuta mai mulți angajatori în dorința de a cere salariaților să se imunizeze împotriva Covid-19.
DIN ACEEASI CATEGORIE...
-

Elon Musk pompează în mame-surogat înainte de Apocalipsă. Miliardarul plătește scump născătoarelor propriilor copii pentru a crea o legiune de progenituri inteligente
Elon Musk, cel mai bogat om al planetei, este in centrul unui nou scandal, dupa o investigație publicata de Wall Street ...
-

Acuzații grave. Rusia ar fi folosit DOGE și Starlink pentru a accesa date sensibile ale guvernului american
Un denunțator din cadrul unei agenții federale americane susține, prin intermediul avocatului sau, ca platforma tehnolog ...
-

După manipularea pietei de capital, familia si apropiatii lui Trump baga banii masiv in criptomonede. Urmeaza o dedolarizare accelerata!
Donald Trump, apropiatii sai și familia sa sunt tot mai intersați de industria cripto, arata o analiza Bloomberg. Trump ...
-

Scandal imens pe manipularea pieței de capital: O "trumpistă" a speculat masiv pe bursă înainte ca Trump să suspende războiul comercial
Aleasa trumpista Marjorie Taylor Greene a cumparat actiuni in valoare de zeci de mii de dolari inainte ca presedintele a ...
-

Parkinson este o boală produsă de om. La fel e si Alzheimer!
În vara anului 1982, șapte consumatori de heroina au fost internați intr-un spital din California, paralizați și m ...
-

Americanii se pregătesc pentru ce e mai rău: își construiesc refugii și se înarmează pentru ziua în care haosul va cuprinde lumea
Odata privita ca o atitudine de nișa, mișcarea cetațenilor pregatiți pentru situații de criza capata tot mai multa amplo ...
-

SECTA GARDNER ȘI INSTITUȚIONALIZAREA PEDOFILIEI ÎN ROMÂNIA
Investigație Jurnalistica de Sorin Roșca Stanescu De la Falsificarea Probelor de Polițista Diugan Dana și Procuroru ...
-

Controversă la Ministerul Finanțelor: O fostă inculpată, numită secretar general. Ar fi primit șpagă un Audi A3 şi o poşetă Louis Vuitton
Guvernul continua sa faca numiri controversate in funcții-cheie. Premierul Marcel Ciolacu a aprobat joi, 3 aprilie, la p ...
-

Șeful SIE vrea să-și albească doctoratul cu ajutorul instanței. Plagiatele din lucrare au fost "clasate" de Comisia de Etică de la Academia SRI
În luna februarie, directorul Serviciului de Informații Externe (SIE), Petru Gabriel Vlase, a dat in judecata Mini ...
-

Ce salarii și sporuri au judecătorii CCR. Lista actualizată a indemnizațiilor celor mai criticați magistrați după hotărârea istorică privind alegerile
Curtea Constituționala a Romaniei (CCR) se afla sub atenția intensa a opiniei publice, mai ales dupa decizia istorica de ...
-

Istoria secretă a Războiului din Ucraina. O investigatie New York Times - America a depășit multe dintre liniile sale roșii
Pe timp de razboi, e mereu dificil sa filtrezi propaganda, care vine din toate direcțiile. Acum de exemplu vedem cum inc ...
-

Rezerva de aur a Germaniei, la mâna lui Donald Trump. Nemții sunt îngrijorați că liderul SUA „încearcă să distrugă cea mai importantă industrie din țară"
Germania pastreaza aur in valoare de peste 100 de miliarde de euro in Statele Unite ale Americii, dar viitorul acestor a ...
-

Un document secret al Pentagonului arată că prioritățile militare ale SUA se reorientează spre China. America va sprijini Europa doar cu descurajarea nucleară a Rusiei
Secretarul Apararii, Pete Hegseth, a reorientat armata americana pentru a acorda prioritate descurajarii Chinei de a cuc ...
-

Războinicii europeni sunt in reparatii capitale! Franta si Marea Britanie au mai multi amirali decat nave. România e ca o rățușcă de plastic pe valuri
Pe fondul entuziasmului spitalicesc al lui Napoleon Starmer și Macron Bonaparte, trebuie sa fac o constatare. Britania c ...
-

Lovitura de teatru: Laura Vicol și Sorin Grindeanu formează un cuplu și urmează să se căsătorească
Laura Vicol și Sorin Grindeanu se iubesc și ar urma sa se casatoreasca in toamna! Unde ar vrea cei doi sa petreaca dupa ...
-

Uluitoarele sume de bani pe care l-au încasat șefii Hidroelectrica anul trecut
Directorii și supraveghetorii Hidroelectria primesc, potrivit contractelor de mandat, o indemnizație totala compusa dint ...
-

E revoltător ce s-a descoperit in documentele desecretizate cu privire la asasinarea lui Kennedy
În documentele publicate cu privire la asasinarea lui Kennedy, jurnalistul american Ben Norton a descoperit ca CIA ...
-

Economist: România se îndreaptă către stagflaţie. E cel mai prost scenariu, demn de o ţară aflată în război
Economia romaneasca a intrat intr-o zona extrem de periculoasa, cu o activitate tot mai redusa pe majoritatea ramurilor ...
-

AMEPIP - Cartoful fierbinte al Premierului Marcel Ciolacu
Cum se derobeaza de raspundere Secretariatul General al Guvernului prin șeful lui secretarul general Mihnea Claudiu Drum ...
-

Blindatele Armatei Române (NATO) vor fi asamblate de Rusia
Sub privirile blande ale serviciilor noastre de informații, Rusia se insinueaza pas cu pas in structurile de aparare ale ...
-
Financial Times si Fox News: Rusia și-ar putea extinde influența în România și Bulgaria cu acordul SUA
Rusia ar putea sa iși extinda influența in zone din Romania și Bulgaria, cu acordul SUA. Asta s-ar putea decide in cele ...
-

Atacul lui Trump asupra elitelor cuprinde aproape toate aspectele vieții americane: "Încearcă să schimbe cultura Americii, precum și politica acesteia"
Președintele Donald Trump iși intensifica atacul pe mai multe fronturi asupra a ceea ce susținatorii vad ca o instituție ...
-

I-au cerut lui Trump să retragă trupele de la baza Kogălniceanu. "Afirmația că România e mai sigură ca niciodată e ridicolă și iresponsabilă"
Doua reviste conservatoare americane au cerut administrației Trump sa iși retraga trupele de la Baza Kogalniceanu din Ro ...
-

Adevărul îngrozitor despre mama lui Putin: cum l-a transformat într-un om barbar experiența ei cu moartea cea mai cumplită
Pe strazile inghețate și acoperite de zapada ale Leningradului, familiile iși duceau rudele moarte - aproape mumificate ...
-

Protejata lui Burduja - cu Porsche si BMW în garaj aterizată la Ministerul Energiei ca "expertă" după ce și fâțâit fundul prin Germania
Mihaela Al Madani, o fosta asistenta de manager din Germania, a fost angajata pe un post de consilier superior in Minist ...
-

Monarhia AI a lui Donald Trump - Despre acceleraționism, NRx și ideologii născute la intersecția dintre tehnologie, religie și filosofie
de Mihnea Maruța (...) Futuriștii italieni, majoritatea oameni de litere, disprețuiau femeile, luptau impotriva moralism ...
-

„Dosarul lui Ciolacu e la el!" - Păgubiții Nordis, în război și cu magistrații. Acuzații grave la adresa a doi judecători și a unui procuror
Revolta pagubiților Nordis continua, dupa ce inculpații din dosar au fost puși in libertate, in luna februarie, in urma ...
-

Șah mat: Triumful tehnocrației - Cum Trump, Elon și elita tehnologică pregătesc terenul pentru o lume nouă
de ERIK WIKSTRÖM Va invit sa va lasați temporar deoparte preconcepțiile cu privire la modul in care funcționeaza lu ...
-

Comisia Europeană vrea să utilizeze economiile cetățenilor pentru apărarea UE. Ursula von der Leyen tinteste 10 trilioane de euro VIDEO
Comisia Europeana estimeaza nivelul total al economiilor neutilizate ale cetațenilor UE la 10 trilioane de euro și inten ...
-

Marea Desecretizare: Joe Biden implicat în dosarele asasinarii lui JFK
Donald Trump a desecretizat peste 80.000 de pagini din dosarul asasinarii lui John Fizgerald Kennedy, de la Dallas. &Ici ...




comentarii
Adauga un comentariuAdauga comentariu